19 Ago Investigadores de Israel logran la primera bioimpresión en 3D de tumor maligno activo
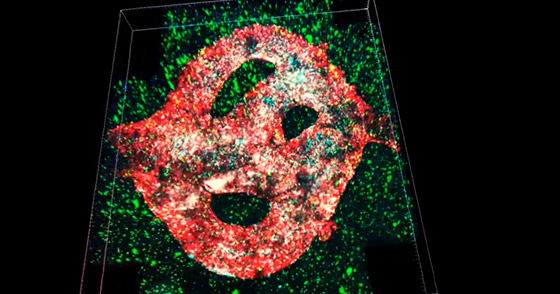
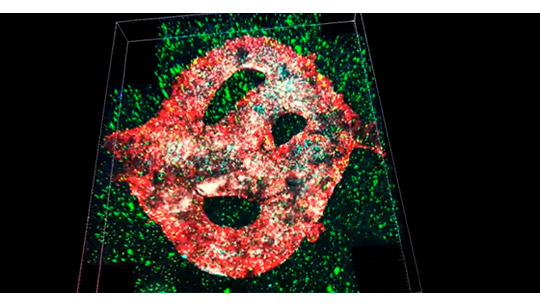
Un equipo de investigadores de la Universidad de Tel Aviv imprimió el primer tumor cerebral maligno viable del mundo utilizando una impresora 3D, recreando los vasos sanguíneos que fluyen y el tejido cerebral circundante.
Hacer clic en el link para ver el video: https://youtu.be/2XvcO13XMY8
El tumor de glioblastoma se basa en muestras de pacientes tomadas durante cirugía y está rodeado por un complejo sistema de tubos similares a vasos sanguíneos a través de los cuales pueden fluir células sanguíneas y medicamentos, simulando un tumor real, explicó la profesora Ronit Satchi-Fainaro, quien dirigió la investigación, de acuerdo con The Jerusalem Post.
El modelo 3D podría ayudar a acelerar el descubrimiento y desarrollo de fármacos u objetivos farmacológicos, y facilitar un nuevo nivel de medicina personalizada para los pacientes, permitiendo una predicción rápida y más sólida de los tratamientos más adecuados.
La investigación fue publicada el miércoles en la revista Science Advances revisada por pares. Se llevó a cabo en colaboración con la estudiante de doctorado Lena Neufeld.
El estudio fue financiado por la Fundación Morris Kahn, el Consejo Europeo de Investigación, el Fondo de Investigación del Cáncer de Israel, la Asociación del Cáncer de Israel, la Fundación de Ciencias de Israel y Check Point Software Technologies.
Hasta ahora, las células cancerosas se cultivaban en placas de Petri de plástico en 2D. “Pondría 1,000 células cada una en 2 placas de Petri y trataría una con un agente quimioterapéutico”, dijo Satchi-Fainaro.
“Al día siguiente, o 3 días después, espero ver que las células tratadas se reduzcan al 10% de las células originales, mientras que el control continuará multiplicándose todos los días”. Cuando los resultados eran buenos, los investigadores trasladaban el agente a la clínica.
“Hemos estado probando nuevos medicamentos como este durante al menos 3 o 4 décadas, incluida yo misma”, explicó Satchi-Fainaro. Pero dijo que 90 de cada 100 compuestos, cuando se trasladan del laboratorio a la clínica, no funcionan.
“¡Es indignante! Y significa que algo anda mal. Empecé a preguntarme. Llegué al punto de pensar que quizás estábamos trabajando con el modelo de cáncer equivocado”.
Lo que realmente le dio la pista a Satchi-Fainaro fue un estudio anterior que completó recientemente en el que su equipo identificó una proteína llamada P-Selectina, producida cuando las células cancerosas del glioblastoma se encuentran con células del sistema inmunológico del cerebro.
“Descubrimos que esta proteína es responsable de una falla en la microglía, lo que hace que apoyen en lugar de atacar a las células cancerosas mortales, lo que ayuda a que el cáncer se propague”, dijo. “Sin embargo, identificamos la proteína en los tumores extraídos durante la cirugía, pero no en las células de glioblastoma cultivadas en placas de Petri de plástico 2D en nuestro laboratorio”.
El modelo está compuesto de células cancerosas y también recrea el “microambiente en el cerebro”: las células gliales especializadas, las células efectoras inmunitarias innatas primarias del sistema nervioso central y los vasos sanguíneos.
Los vasos están conectados a un sistema de tubos a través del cual el equipo puede hacer fluir glóbulos rojos y blancos y diferentes medicamentos al modelo de tumor para predecir mejor qué es efectivo.
“Cada modelo se imprime en un biorreactor que hemos diseñado en el laboratorio utilizando un hidrogel muestreado y reproducido de la matriz extracelular extraída del paciente, simulando así el tejido mismo.
“Las propiedades físicas y mecánicas del cerebro son diferentes a las de otros órganos, como la piel, el pecho o los huesos. El tejido mamario se compone principalmente de grasa; el tejido óseo es principalmente calcio. Cada tejido tiene sus propias propiedades, que afectan el comportamiento de las células cancerosas y cómo responden a los medicamentos”, dijo Satchi-Fainaro.
Dijo que el modelo realmente recrea las propiedades mecánicas cruciales del tumor y el entorno en el que crece, como la plasticidad y la elasticidad.
Una vez creado el modelo, el equipo trató de demostrar por qué funciona mejor que en el anterior modelo en 2D.
“Primero, probamos una sustancia que inhibía la proteína que habíamos descubierto recientemente, P-Selectina, en cultivos de células de glioblastoma crecidas en placas de Petri en 2D, y no encontramos diferencias en la división y migración celular entre las células tratadas y las células de control que no recibieron tratamiento”, explicó Satchi-Fainaro.
“Por el contrario, tanto en los modelos animales como en los modelos bioimpresos en 3D, que sobreexpresan la proteína, pudimos retrasar el crecimiento y la invasión del glioblastoma bloqueando la proteína P-Selectina”.
A continuación, el equipo llevó a cabo la secuenciación genética de las células cancerosas cultivadas en el modelo 3D y las comparó con las cultivadas en la placa de Petri y el cerebro de un paciente. El experimento mostró una semejanza mucho mayor entre los tumores bioimpresos en 3D y las células del paciente, en comparación con los cultivados en el modelo anterior.
Finalmente, midieron la tasa de crecimiento del tumor.
“El glioblastoma es una enfermedad agresiva en parte porque es impredecible. Cuando las células cancerosas heterogéneas se inyectan por separado en animales modelo, el cáncer permanecerá latente en algunos, mientras que en otros, un tumor activo se desarrollará rápidamente ”, dijo.
En la placa, todos estos tumores crecen al mismo ritmo, mientras que en el tumor 3D se mantiene la heterogeneidad.
Satchi-Fainaro dijo que el equipo tardó 5 años en crear el tumor bioimpreso en 3D.
“Tuvimos muchas dificultades y desafíos en el camino”, dijo. Pero ahora esperan que este avance cambie la investigación del cáncer para siempre.
“Si tomamos una muestra del tejido de un paciente, junto con su matriz extracelular, podemos bioimprimir en 3D de esta muestra 100 pequeños tumores y probar muchos medicamentos diferentes en varias combinaciones para descubrir el tratamiento óptimo para este tumor específico”, dijo Satchi-Fainaro.
“Alternativamente, podemos probar numerosos compuestos en un tumor bioimpreso en 3D y decidir cuál es el más prometedor para un mayor desarrollo e inversión como fármaco potencial.
“Pero quizás el aspecto más emocionante es encontrar nuevas proteínas y genes que se puedan administrar con fármacos en las células cancerosas, una tarea muy difícil cuando el tumor está dentro del cerebro de un paciente humano o animal modelo”.
Ella dijo que el plan final es crear otros sitios de tumores como lo hicieron para el glioblastoma, como los tumores cerebrales que se desarrollan en las etapas avanzadas del cáncer de pulmón o de mama.
Están iniciando un ensayo clínico en el Centro Médico Sheba para validar esta técnica. Si, después de 3 a 6 meses, se demuestra que el paciente y el modelo responden de manera consistente a los tratamientos, “imagine cuánto tiempo y dinero ahorraremos”, dijo Satchi-Fainaro.
“Nuestra innovación nos brinda un acceso sin precedentes, sin límites de tiempo, a tumores 3D que imitan mejor el escenario clínico, lo que permite una investigación óptima”.
Reproducción autorizada con la mención siguiente: ©EnlaceJudío
Fuente: Enlace Judío
https://www.enlacejudio.com/2021/08/18/investigadores-de-israel-logran-la-primera-bioimpresion-en-3d-de-tumor-maligno-activo/